Qu’est qu’un cycle?
Toute forme représentant un hexagone fermé est un cycle, par exemple le carbone lié par des liaisons covalentes comme ceci en est un.
Une molécule est une liaison d’atomes. Chaque sommet de l’hexagone représente un atome de carbone s’il n’y a pas d’autre dénomination symboles du tableau périodique ou composé moléculaire. (Un cadeau pour celui qui cliquera 3 fois sur les trois liens hexagone : hexagone , hexagone).
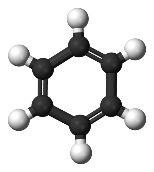
Sur ce cycle on voit un hexagone de 6 atomes de carbones en noirs liées chacun à 6 atomes d’oxygènes en périphérie.
Exemple de cycle : la Mésomérie du benzène
Un rond dans un cycle permet d’aborder Cycle avec des liaisons doubles supplémentaires positionnables à n’importe quel endroit de l’espace. On parle aussi de résonance.
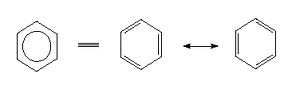
Sur les encyclopédies en ligne : vous trouverez beaucoup de molécules représentés sous forme d’hexagone ou de pentagone, l’hexagone est le cycle (dans lequel l’oxydation et l’entropie sont diminuées.)
Le pentagone quant à lui est le sucre, ou aussi appelé « ose » composant de la chimie organique essentiel à la nature et à l’humanité (réplication de l’ADN (ribose, désoxyribose) glycoprotéine, glycolyse, métabolise l’énergie au sein des mitochondries dans tout les corps cellulaires.
On peut noter que cela facilite la mémoire visuelle et la mémoire des formes.
La représentation de CRAM
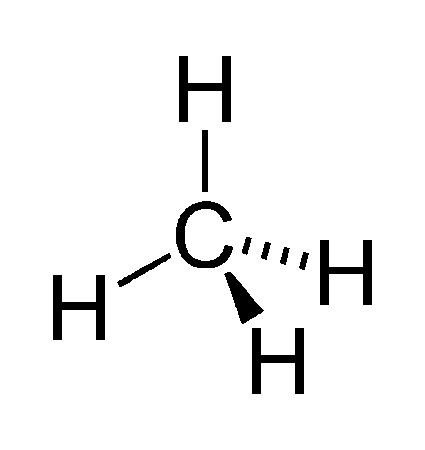
Il existe plusieurs représentations dans le plan et son espace, certaines molécules peuvent être situées en arrière ou d’autre en avant du plan.
Un trait simple indique une liaison dans le plan.
Un trait plein en forme de triangle de la liaison entre le carbone et l’hydrogène indique une liaison entre les deux atomes légèrement en avant du plan et les triangles en pointillés indique une liaison en arrière du plan.
Cela permet de représenter les molécules dans une fausse 3D et laisse place à notre pensée visuelle.

Des représentations en 2D volumétrique et une couleur pour chaque atome en rouge sont aussi efficaces l’oxygène, en violet le nitrogène, en blanc l’hydrogène, en gris/noir pour le carbone.
La projection de Haworth
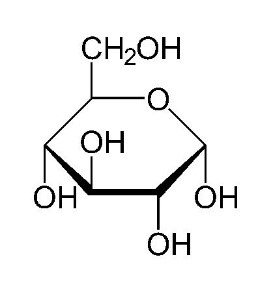
Dans le plan les traits les plus épais indiquent une position spatiale plus proche par rapport au lecteur, un trait plus fin au contraire une distance proximale plus éloignée.
La projection Haworth est un moyen simple de représenter une molécule de sucre (ose)
On remarque que c’est par l’atome d’oxygène O du composé OH que la liaison se fait.
Ou bien par l’atome de Carbone du composé CH2OH.
La projection de Fischer
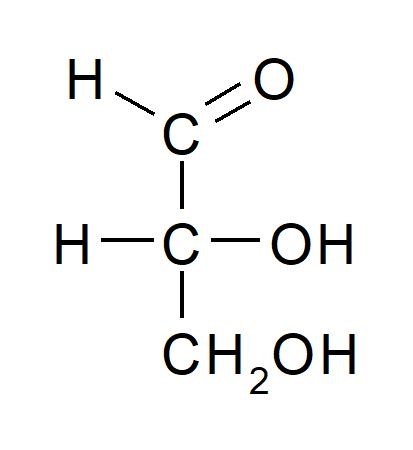
Dans la projection de Fischer la place centrale est réservée au carbone, c’est le squelette ou l’armature de la représentation.
La Formule brute
Ex : C2H6O
Indispensable mais reprend pour ainsi dire les lettres des éléments du tableau périodique avec une valeur numérique qui définit le nombre d’atomes, d’anion ou de cation de chaque composé moléculaire. Il s’agit toujours de regarder la formule brute en premier lieu.
Je complète aujourd’hui cette article pour vous montrer comment deviner le nom d’une molécule à partir de sa formule brute, en effet c’est un bon exercice pour travailler votre intelligence sachez qu’il existe cinq composés différents que l’on peut déterminer : Ionique (+ ou -), covalents, oxyde, hydrate, acide sachant que des oxydes ou acides peuvent être covalents. (A compléter plus tard).
Formule développée plane : représente toutes les liaisons en détail, couteux en termes de temps et rébarbatif, à utiliser au début lorsque l’on débute en chimie.
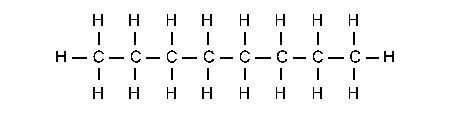
Formule Semi-Développée :
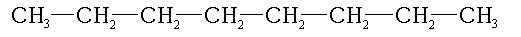
Ne représente que certaines liaisons de composés moléculaires peut s’exprimer orthogonalement (des deux côtés) voir mon article sur l’influx nerveux.
Formule développée
Permet de représenter la formule dans l’espace, en 2 ou 3 dimensions ce qui est très pratique pour différencier les isomères. Un isomère étant comme son nom l’indique des molécules qui ont la même formule brute.
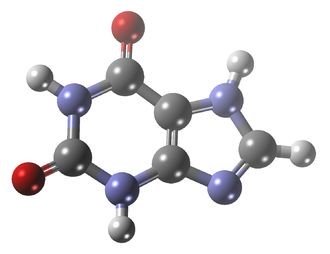
Mettre en avant des atomes liés particuliers, l’exemple de la xanthine :
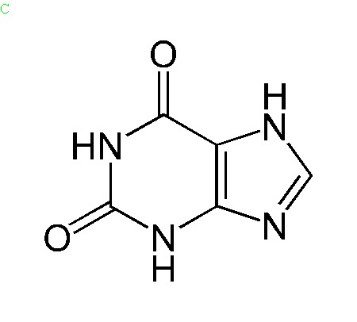
Voici la formule de la Xanthine, les sommets qui ne sont pas représentés sont des atomes de carbone. A partir d’une formule brute on peut compléter cette représentation.
Vous remarquerez que les atomes d’azote du composé NH appelées en anglais Nitrogène sont mis en avant par rapport à son atome d’hydrogène pour bien montrer le nitrogène est lié 2 ou même 3 fois à chaque fois.
La structure de Lewis
La structure de Lewis permet de représenter pour chaque atome. Les électrons sur la dernière couche externe ainsi que les électrons de valence et j’en ai déjà parlé sur mon article du tableau périodique, ce sont les électrons qui participent à la liaison chimique lors de liaisons covalentes.
Malgré ses limites formelles, la représentation de Lewis est très utilisée en chimie organique pour préparer les mécanismes réactionnels.
Au niveau de l’atome :


Lewis est utilisé soit au niveau de l’atome en lui-même soit à un degré plus haut au niveau de la molécule. Commençons par l’atome, par une simple lecture du tableau périodique (voir mon article) vous pouvez savoir combien d’électrons sont sur la couche externe.
On sait qu’un atome de nitrogène a un numéro atomique de 7 donc sur ses 2 couches : K2 L5.
A partir du moment ou un atome a plus de quatre électrons sur sa couche externe on lie les électrons par deux sous forme d’un trait. (Doublet non liant). Un doublet est stable alors qu’un électron célibataire est réactif.
L’atome de soufre qu’on verra plus loin au niveau de la molécule a 6 électrons sur sa dernière couche et peut avoir 2, 4, ou 6 électrons de valence donc on peut faire 3 doublets non liants.
Nous allons voir par la suite que la structure de Lewis est très utile pour calculer les états d’oxydation domaine de la chimie inorganique sauf pour les composés cristallins(solides) que j’expliciterai dans mon article sur le tableau périodique quantique pour les propriétés du Mercure.
Au niveau de la molécule :
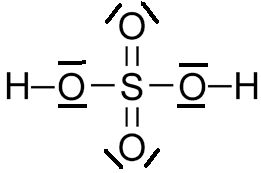
1/Acide Sulfurique
La formule de Lewis au niveau de la molécule a l’avantage de montrer les doublets non liants c’est à dire les électrons sur la dernière couche qui ne participent pas à la liaison chimique.
Partons de la formule brute du pour notre première molécule c’est-à-dire l’acide Sulfurique (Soufre) :
Formule brute : H2 S O4 : 2 atomes d’Hydrogène 1 atome de Souffre et 4 atomes d’Oxygène
On sait qu’un atome de souffre qui est l’atome clé de notre composant a un numéro atomique de 16 dans le tableau périodique soit un nombre de charges (nombres de protons (+) et d’électrons (-) de 16 (Je rappelle que l’atome est neutre)
Donc sur les 3 couches :
K L M (la règle du duet (2) sur la couche K s’applique sur la première couche,
La règle de l’octet (8) L sur la deuxième couche
La configuration électronique de la 3ème couche M est donc de 16-8-2 = 6
On doit donc respecter 6 liaisons pour l’atome de Soufre.
On a dû casser les doublets non liants de l’atome de souffre ce qui veut dire que cette représentation au niveau atomique et on remarque à chaque fois 2 doublets non liants soit 4 électrons pour l’oxygène.
L’Oxygène à un numéro atomique de 8 donc on a 2 électrons sur la couche K et 6 sur la couche L donc 6 électrons de valence également alors qu’il n’a que deux couches.
2/ Composé organique(Carbone)
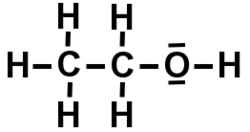
Molécule d’Ethanol
Un atome de carbone peut avoir 2 ou 4 électrons de valence, un atome d’hydrogène a 1 électron de valence. Un atome d’oxygène en a 2 mais a 6 atomes sur sa dernière couche donc il aura deux doublets non liant.
3/ Composé ionique
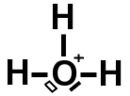
Ion Positif dans la structure de Lewis.
Ici le composé moléculaire est formé de 3 atomes d’hydrogène avec un seul électron de valence sur la couche K (1) et pour l’oxygène on a 6 électrons sur la dernière couche K (2) L (6).
On voit qu’il a déjà 3 liaisons électroniques avec des atomes d’hydrogène. Un doublet non liant plein et un doublet non liant vide (ou cassé).
Ce doublet non liant vide représenté en blanc veut dire qu’un électron s’est libéré pour transformer l’atome d’oxygène en ion positif.
Enfin pour finir je vous parlerai de chimie organique et donc notamment de la chimie du carbone, d’azote aussi appelé nitrogène, de chlore et de brome. par opposition à la chimie des minéraux.
Les notations internationales chimiques
Il existe des notations qui permettent de mieux comprendre comment s’agencent les molécules sur le plan atomique.
Vous trouverez dans la version Anglaise de Wikipédia bien plus riche en termes de contenu que la version française quant à la terminologie de ces nomenclatures.
Je compléterai cet article car elles obéissent à des règles complexes qui ont notamment été établies par l’union internationale pure de chimie appliquée (IUPAC), je pense notamment à la forme structurale.
Enfin pour finir voici une petite liste des logiciels que vous pouvez utiliser sur ordinateur pour représenter des molécules :
Voici quelques solutions (gratuites pour la plupart) qui transforment automatiquement un simple nom (ou formule/IUPAC/SMILES) en modèle 3D manipulable ; elles couvrent aussi bien les molécules discrètes que les composés ioniques cristallins :
| Outil | Où ? | Ce qu’il suffit de faire | Points forts / limites |
|---|---|---|---|
| MolView | Web (molview.org) | Tape le nom (« caféine », « chlorure de sodium », etc.) dans la barre de recherche ➜ le viewer charge la structure PubChem et l’affiche en 3D (bouton « 3D » ou « 2D → 3D »). | Extrêmement rapide, aucune installation, export .mol/.pdb possible. Modèles cristallins simplifiés pour les solides ioniques. MolView |
| PubChem 3D Viewer | Web (pubchem.ncbi.nlm.nih.gov) | Recherche ton composé ➜ onglet 3D conformer ➜ visualisation interactive, téléchargement (SDF, PDB). | Base de données géante ; propose plusieurs conformères + génération d’images HD. PubChem |
| ChemSpider | Web (chemspider.com) | Recherche par nom ➜ clic sur « 3D » (JSmol) pour manipuler la molécule. | 130 M structures issues de multiples sources ; export facile. chemspider.comblogs.rsc.org |
| WebQC 3D Molecular Viewer | Web (webqc.org) | Entrer directement la formule ou le nom, valider. | Dépannage ultra‑léger ; pas d’options avancées. webqc.org |
| Avogadro 2 | Logiciel (Windows/Linux/macOS) | Menu : Build → Insert → SMILES/IUPAC Name ou Extensions → Import → PubChem… | Open‑source complet : édition, optimisation géométrique, rendu publication. Idéal hors‑ligne. two.avogadro.cc |
| Jmol / JSmol | Logiciel & librairie Web | Ouvre le fichier récupéré (mol, cif, pdb, etc.) ou intègre JSmol dans ta page HTML pour charger par nom via scripts. | Libre, scriptable ; gère molécules, biomolécules et cristaux. jmol.sourceforge.net |
| Materials Project | Web (materialsproject.org) | Cherche le solide (ex. « NaCl » ou mp‑25260) ➜ Interactive Crystal Structure pour la maille 3D. | Parfait pour composés ioniques/cristaux : maille, plans, propriétés ab initio. Compte gratuit requis. next-gen.materialsproject.org |
| RCSB PDB Mol* | Web (rcsb.org/3d-view) | Pour biomolécules (protéines, ADN) : saisie du code PDB ou nom, visualisation immédiate. | Puissant pour macromolécules, superpositions, surfaces, etc. |



